1.1. КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ
Коррозия – это самопроизвольное разрушение металлов в результате химического или электрохимического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или бетон, керамика, дерево или полимер.
В ГОСТ 9.072-17 дано следующее определение:
Коррозия — процесс разрушения (ухудшения) свойств материала, вызванное химическими, электрохимическими или микробиологическими реакциями, протекающими под воздействием окружающей или какой-либо другой сред.
Коррозия, являясь нежелательным процессом, приводит к регенерации исходных (природных) соединений металлов: оксидов, сульфидов, карбонатов и других, термодинамически более устойчивых, чем чистые металлы.
Энергия, затраченная на получение металлов из руд, накапливается в них в виде свободной энергии и делает их активными, термодинамически неустойчивыми. Металл стремится вновь перейти в то естественное состоя- ние, в котором существует в природе. Причем, этот процесс всегда протекает самопроизвольно, с уменьшением энергии.
Следовательно, термодинамическая неустойчивость является основной причиной разрушения металлов и сплавов. По знаку и величине энергии можно судить о направлении и интенсивности коррозионных процессов.
Классификация коррозионных процессов
- по механизму процесса
- по характеру коррозионных разрушений
- по эксплуатационным условиям
- по видам коррозионно-механических напряжений
Все эти виды классификации условны, и в литературе можно встретить различные представления классификаций коррозионных процессов.
1.2. КЛАССИФИКАЦИЯ ПО МЕХАНИЗМУ ПРОЦЕССА
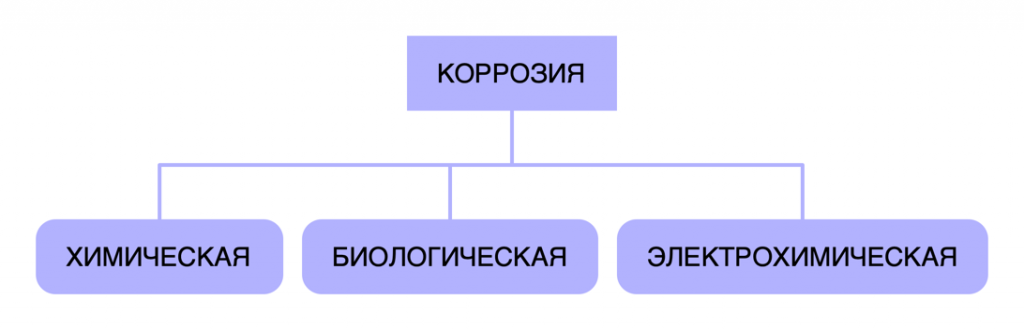
1.2.1 ХИМИЧЕСКАЯ КОРРОЗИЯ
Химическая коррозия – это самопроизвольное разрушение металлов под действием окислителей – неэлек- тролитов, обычно газов и органических жидкостей, не проводящих электрический ток. В соответствии с этим различают:
- газовую коррозию
- коррозию в жидких неэлектролитах.
Химическая коррозия – это обычная гетерогенная окислительно-восстановительная реакция с участием металла и окислителя из окружающей среды. Она может протекать в любых средах и не сопровождается возник- новением электрического тока.
В связи с тем, что этот вид коррозии протекает, в основном, равномерно по всей поверхности металла, она менее опасна, чем электрохимическая коррозия. В промышленных условиях металлы нередко нагреваются до высоких температур, что способствует ускорению химической коррозии.
Газовая коррозия
Газовая коррозия – это разрушение металла в контакте с сухими газами при высоких температурах. Она имеет место при работе двигателей внутреннего сгорания, при химической обработке металлов, горячей прокатке, ковке, в энергетических установках и др. При газовой коррозии происходит химическое взаимодействие металла с активными средами (CO2; H2S; O2; SO2; галогенами).
Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Продуктами коррозии могут быть оксиды, хлориды, сульфиды.
Механизм газовой коррозии сводится к адсорбции (поглощению) молекул газа, например, кислорода, поверхностью металла и их химическому взаимодействию с образованием солевых или оксидных пленок. При этом образуются разные по своему составу, толщине и свойствам пленки. Такие металлы как, например, алюминий, цинк, хром, никель при окислении покрываются плотной и прочной оксидной пленкой (Al2O3, ZnO, Cr2O3, NiO), которая защищает их от дальнейшего разрушения. Например, серебро на воздухе чернеет – это на его поверхности при участии содержащихся в воздухе соединений серы образуется сульфид серебра. На других металлах (например, железо, медь) образуются плёнки с пористой структурой, не препятствующие дальнейшему развитию процесса коррозии: FeO, Fe2O3, CuO.
В окислении меди участвует диоксид углерода, окружающего воздуха. Подвергшаяся коррозии медь покрывается красивой по цвету патиной – основным карбонатом меди.
Коррозионная плёнка образующаяся на поверхности металла, будет обладать защитными свойствами в
том случае, если она является сплошной, беспористой, имеет хорошее сцепление с металлом, имеет с ним близкий коэффициент термического расширения, обладает хорошей прочностью, твердостью и износостойкостью. Скорость процесса газовой коррозии зависит от природы металла (сплава), характера газовой среды и температуры.

В процессе охлаждения на воздухе на поверхности стали образуется многослойная окисная плёнка толщиной 5–60 мкм. Разность потенциалов прокатной окалины и стали составляет 0,3 V, что делает её катодом по отноше- нию к анодной поверхности стали и вызывает высокую коррозионную активность.
Коррозия в жидкостях – неэлектролитах
Жидкости — неэлектролиты – это жидкие среды, которые не являются проводниками электричества . К ним относятся :
- органические (бензол, фенол, хлороформ, спирты, керосин, нефть, бензин);
- неорганического происхождения (жидкий бром, расплавленная сера и т.д.).
Чистые неэлектролиты не реагируют с металлами, но с добавлением даже незначительного количества примесей возникает взаимодействие и процесс резко ускоряется. Например, если нефть будет содержать серу или серосодержащие соединения (сероводород, меркаптаны), то процесс химической коррозии ускоряется. Если вдобавок увеличится температура, то в жидкости окажется растворенный кислород и химическая коррозия усилится.
Присутствие в жидкостях – неэлектролитах влаги обеспечивает интенсивное протекание коррозии уже по электрохимическому механизму.
1.2.2 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Электрохимическая коррозия – наиболее распространённый вид коррозии металлов, это разрушение металла в среде электролита с возникновение внутри системы электрического тока .
Электрохимическая коррозия – это процесс, который протекает при обязательном присутствии электролита и металлов с низкими и высокими электродными потенциалами.
Электролит образует вода, любые природные осадки и другие токопроводящие жидкости .
Наличие разности потенциалов обусловлено как правило двумя факторами :
- неоднородностью металла, то есть наличием инородных включений;
- непосредственным касанием изделий из различных металлов .
В электролите неоднородные металлы образуют короткозамкнутый гальванический элемент.
Такое сочетание приводит к растворению металла с более низким электродным потенциалом, что и является электрохимической коррозией.
Скорость этого процесса сильно зависит от наличия солей в растворе и его температуры.
Механизм электрохимической коррозии может протекать по двум вариантам:
-
Гомогенный (однородный по своему составу) механизм электрохимической коррозии:
-
Гетерогенный (разнородный по составу) механизм электрохимической коррозии .
Гомогенный механизм коррозии определяется следующими факторами:
-
поверхностный слой металла рассматривается как гомогенный и однородный;
-
причиной растворения металла является термодинамическая возможность
-
протекания катодного или же анодного процесса;
-
катодные и анодные участки мигрируют по поверхности во времени ;
-
скорость протекания электрохимической коррозии зависит от кинетического фактора (времени);
-
однородную поверхность можно рассматривать как предельный случай,который может быть реализован и в жидких металлах .
Гетерогенный механизм коррозии определяется следующими факторами:
-
у твердых металлов поверхность негомогенная, так как разные атомы занимают в сплаве различные положения в кристаллической решетки;
-
гетерогенность наблюдается при наличии в сплаве инородных включений.
Электрохимическая коррозия представляет собой два одновременно протекающих процесса (катодный и анодный), которые кинетически зависят друг от друга .
На некоторых участках поверхности электрохимическая коррозия может иметь локальный характер . Растворение основного металла происходит на анодах . Поверхность любого металла состоит из множества короткозамкнутых через сам металл микроэлектродов . Контактируя с коррозионной средой образующиеся гальванические элементы способствуют электрохимическому разрушению .
Причины возникновения местных гальванических элементов могут быть следующие:
Неоднородность сплава:
- неоднородность металлической фазы, обусловленная неоднородностью сплава и наличием микро- и макровключений ;
- неравномерность окисных пленок на поверхности за счет наличия макро- и микропор, а также неравномерного образования вторичных продуктов коррозии;
- наличие на поверхности границ зерен кристаллов, выхода дислокации (нарушение кристаллической решетки твердого тела) на поверхность.
Неоднородность среды:
- область с ограниченным доступом окислителя будет анодом по отношению к области со свободным доступом, что ускоряет электрохимическую коррозию .
Неоднородность физических условий:
- облучение (облученный участок – анод)
- воздействие внешних токов (место входа блуждающего тока – катод, место выхода анод)
- температура (по отношению к холодным участкам, нагретые являются анодами) т.д.
При работе гальванического элемента одновременно протекает два электродных процесса:
- анодный – ионы металла переходят в раствор, при этом происходит реакция окисления;
- катодный – избыточные электроны ассимилируются молекулами или атомами электролита, которые при этом восстанавливаются. На катоде проходит реакция восстановления.
Коррозия металла происходит именно на аноде.
При соприкосновении двух электропроводящих фаз (например металл – среда), когда одна из них заряжена положительно, а другая отрицательно, между ними возникает разность потенциалов.
Скачок потенциалов в процессе электрохимической коррозии может происходить по двум причинам:
- При достаточно большой энергии гидратации ионы металла могут отрываться и переходить в раствор, оставляя на поверхности эквивалентное число электронов, которые определяют ее отрицательный заряд . Отрицательно заряженная поверхность притягивает к себе катионы (положительно заряженные ионы) металла из раствора . Так на границе раздела фаз возникает двойной электрический слой (ДЭС).
- На поверхности металла разряжаются катионы электролита . Это приводит к тому, что поверхность металла приобретает положительный заряд, который с ионами раствора образуют двойной электрический слой.
Иногда возникает ситуация, когда поверхность не заряжена и, соответственно, отсутствует ДЭС. Потенциал, при котором это явление наблюдается называется потенциалом нулевого заряда . У каждого металла потенциал нулевого заряда свой . Величина электродных потенциалов оказывает очень большое влияние на характер коррозионного процесса.
Электрохимическая коррозия наблюдается при контакте двух разнородных металлов . В электролите они образуют гальванопару. Более электроотрицательный из них будет анодом . Анод в процессе будет растворятся . При этом идет замедление или даже полное прекращение электрохимической коррозии на катоде . Химический процесс электрохимической коррозии описывается следующими формулами.
На аноде происходит окисление и растворение металла по схеме:
Me0 – nе– -> Men+
В нейтральной или щелочной среде водородная деполяризация протекает в тех случаях, когда доступ кислoрода, как более сильного окислителя, к поверхности металла ограничен. Это может иметь место под толстым слоем воды или в кислых растворах, в которых растворимость кислорода очень низка.
Водородная деполяризация сопровождается восстановлением на катодных участках водорода в кислой среде:
2H+ + 2e– = H2
В нейтральной или щелочной среде водородная деполяризация протекает в тех случаях, когда доступ кислорода, как более сильного окислителя, к поверхности металла ограничен. Это может иметь место под толстым слоем воды или в кислых растворах, в которых растворимость кислорода очень низка.
Кислородная деполяризация обусловлена восстановлением атмосферного кислорода, растворённого в коррозионной среде, и протекает по реакции:
О2 + 2Н2О + 4e– = 4OH−
Кислотность среды (рН среды) и коррозия
Окислительные свойства основных деполяризаторов (Н+, Н2О, О2) зависят не только от их химической природы, но и от кислотности среды рН. При этом величина электродного потенциала в случае водородной деполяризации
определяется уравнением:
φН+ ⁄ Н2 = −0,059рН,
а в случае кислородной деполяризации:
φО2 ⁄ О2– = +1,23 − 0,059рН.
Из этого следует, что с уменьшением рН (т.е. увеличением кислотности среды) окислительные свойства указан-
ных деполяризаторов возрастают. Причем при водородной деполяризации электрохимической коррозии могут подвергаться металлы с электродным потенциалом более отрицательным, чем у водородного электрода в соответ- ствующей среде (или активные металлы, расположенные в ряду напряжений слева от водорода). При кислородной деполяризации коррозии могут подвергаться и неактивные металлы вплоть до серебра:
φ0 Ag+ ⁄ Ag = 0,8 B
Механизм электрохимической коррозии в электролитах включает в себя пять основных этапов. Для случая коррозии углеродистой стали в воде или влажном воздухе процесс протекает следующим образом:
Адсорбция молекул воды на поверхности стали:
Fe+H2O —> Fe:O—>2H(адсорбция)
Ионизация атомов железа с образованием гидратированных в воде ионов и некомпенсированных электронов
на анодных участках металла:
Fe…H2O (адс) —> Fe+2H2O + 2e–
Прием электронов деполяризаторами (в нейтральных растворах кислородом) на катодных участках:
O2 + 2H2O + 4e– —> 4OH–
Образование в растворе гидроксида железа:
Fe+2 + 2OH– —> Fe (OH)2
Окисление гидроксида железа Fe+2 до гидроксида железа Fe+3 и преобразование его в окончательный продукт
коррозии Fe2O3 × H2O. Эта стадия протекает в средах с достаточной концентрацией кислорода. Суммарная реакция коррозии стали будет иметь вид:
4Fe (железо) + 2H2O (вода) + 3O2 (воздух) —> 2Fe2O3 × H2O (ржавчина)
Ниже показана принципиальная схема работы коррозионного элемента.
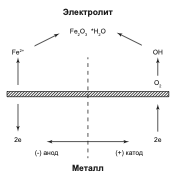
Ток коррозии можно представить в виде закона Ома:
![]()
где φК, φА – потенциалы катодных и анодных участков;
RПК, RПА, – соответственно поляризационное сопротивление на катоде и аноде;
RОМ – сопротивление электролита.
Определяющие скорость коррозии соотношения обычно наглядно представляются в виде коррозионных диаграмм , где потенциалы анода и катода представляются в функции силы тока.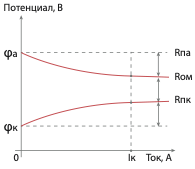
Скорость и характер коррозионного процесса определяется в конечном итоге величиной стационарного потен- циала металла φ, отвечающей установившейся скорости ионизации металла.
Усредненные значения стационарных потенциалов металлов в морской воде (по водородному электроду, В) можно расположить в ряд.
| Наименование металла | Стандартный потенциал по водороду, В |
|---|---|
| Магний | — 1,45 |
| Магний, анодный сплав | -1,20 |
| Цинк | -0,80 |
| Алюминиево – магниевый сплав | -0,74 |
| Алюминиево – цинковый сплав | -0,70 |
| Алюминий | -0,53 |
| Кадмий | -0,52 |
| Дюралюминий | -0,50 |
| Железо | -0,50 |
| Углеродистая сталь | -0,40 |
| Стали, высоколегированные ферритно – мартенситные (активное состояние) | -0,32 |
| Стали, высоколегированные аустенитные (активное состояние) | -0,32 |
| Олово | -0,25 |
| Никель (активное состояние) | -0,12 |
| Латунь | -0,11 |
| Бронза | -0,11 |
| Медь | -0,08 |
| Купроникель | -0,02 |
| Стали, высоколегированные ферритно – мартенситные (пассивное состояние) | +0,03 — +0,10 |
| Никель (пассивное состояние) | +0,05 |
| Титан | +0,10 — +0,15 |
| Серебро | +0,12 |
| Монель | +0,17 |
| Стали, высоколегированные аустенитные (пассивное состояние) | 0,20 |
| Платина | 0,40 |
Указанные численные значения и порядок металлов в ряду носят ориентировочный характер, так как зависят от состава металла и морской воды.
Многочисленные факторы, влияющие на коррозионное поведение сплавов, не позволяют провести расчет коррозионных свойств сплава исходя из его состава. Однако известны основные направления повышения коррозионной стойкости сплавов.
Таблица: Устойчивость металла к коррозии вследствие термодинамической стабильности
| Стационарный потенциал металла | Характеристика термодинамической стабильности | Вероятные коррозионные процессы |
|---|---|---|
| Отрицательнее – 0,4 В | Металлы, термодинамически неустойчивые (неблагородные) | Могут корродировать в нейтральных водных средах, не содержащих кислород |
| Между – 0,4 В и 0,0 В | Металлы, термодинамически недостаточно устойчивые. | Могут корродировать в нейтральных водных средах только при наличии кислорода или окислителей. В кислых средах могут корродировать в отсутствии кислорода. |
| Между 0,0 В и +0,28 В | Металлы промежуточной термо- динамической стабильности. | В отсутствии кислорода устойчивы в кислых и нейтральных средах. При наличии кислорода или окислителей могут корродировать в этих средах. |
| Положительнее 0,28 В | Металлы высокой термоди- намической стабильности (благородные). | Не корродируют в нейтральных средах при наличии кислорода. В кислых средах корродируют при наличии окислителей или кислорода. Корродируют в средах, содержащих комплексообразователи. |
Устойчивость металла к коррозии вследствие термодинамической стабильности
Основные направления повышения коррозионной стойкости сплавов.
| Основные направления | Конкретные пути | Низколегированные стали | Нержавеющие стали |
|---|---|---|---|
| Создание сплавов, образующих более надежный защитный слой продуктов коррозии | Введение компонентов, способствующих образованию плотной защитной пленки на поверхности сплава | Введение меди | Легирование молибденом для сред, содержащих ион хлора. Легирование хромом, алюми- нием, кремнием для повышения жаропрочности. |
| Уменьшение катодной активности сплава | Уменьшение площади микро катодов. | Уменьшение площади микро катодов. | Легирование мышьяком, сурьмой, висмутом для повышения устойчивости в кислотах. |
| Уменьшение анодной активности сплава | Уменьшение площади анодной фазы. | Введение меди | Высокотемпературный отжиг для введения карбидов хрома в тело зерна. Устранение растягивающих внутренних напряжений |
| Введение компонентов, повышающих термодинамическую стабильность. Введение компонентов, повышающих пассивируемость анодной фазы. | Легирование хромом, кремнием | Легирование хромом, кремнием |
1.2.3. БИОЛОГИЧЕСКАЯ КОРРОЗИЯ
Коррозию металлов, протекающую под воздействием биологических факторов, могут вызывать как сами микро– и макроорганизмы, так и продукты их жизнедеятельности. В первом случае это первичный процесс, а во втором случае биокоррозию следует рассматривать как вторичный процесс. Конечными и промежуточными продуктами биохимических реакций могут быть органические кислоты, аммиак, сероводород и др., многие из них агрессивны по отношению к различным металлам.
В атмосферных условиях биологическая коррозия металла начинается там, где на поверхности изделия имеются участки, на которых могут поселяться споры плесневых грибов и бактерий. Обычно это места контактов металла с неметаллом, способных быть пищей для плесневых грибков и бактерий (лаки, краски, пластмассы, резина, нефтепродукты и т.д.). За счет влаги на поверхности металлов и выделения грибами органических кислот коррозия металлических изделий усиливается.
К разрушителям металлов относятся также водородные бактерии, железобактерии, нитрифицирующие бакте- рии, серобактерии, метанообразующие бактерии и др.
Так, например, в подземных условиях чаще всего причиной биокоррозии являются водородные и сульфатредуцирующие бактерии. Первые в процессе своей жизнедеятельности используют водород, выделяющийся при водородной деполяризации катода, чем способствуют удалению с поверхности металла налипающих пузырьков водорода. Эта плёнка играет роль барьера между металлом и агрессивной средой, защищая металл от её воздействия. Сульфатредуцирующие бактерии используют водород для восстановления сульфатов, почти всегда имеющихся рядом с металлом и других солей серной кислоты:
SO42– + 8Hо —> S2– + 4H2O
Ион S2– может образовывать сероводород, являющийся сильнейшим агрессором для черных металлов. Образующийся сероводород окисляется затем до свободной серы:
2H2S+O2 —> 2H2O + S ;
а последняя – до серной кислоты:
S + O2 + 2H2O —> H2SO4,
которая является окислителем многих металлов.
В условиях контакта с морской водой наиболее агрессивны морские обрастатели и бактерии. Для защиты от биологической коррозии используют контактные и летучие фунгициды.
1.3. ВИДЫ КОРРОЗИИ ПО ХАРАКТЕРУ РАЗРУШЕНИЯ
Существует множество различных классификаций коррозии по характеру разрушения. Однако, можно выделить следующие виды:
- сплошную – охватывающую всю поверхность металла;
- местную – охватывающую отдельные участки поверхности;
- равномерную – протекающую с приблизительно одинаковой скоростью по всей поверхности;
- неравномерную – протекающую с неодинаковой скоростью на различных участках поверхности;
- избирательную – в виде растворения отдельных компонентов сплава;
- пятнами – в виде пятен диаметром более 50мм и глубиной до 2мм;
- язвенную – в виде язв диаметром от 2 до 50мм;
- точечную (питтинг) – в виде отдельных точек диаметром до 2мм;
- межкристаллитную – в виде избирательного разрушения границ зерен;
- расслаивающую – вызывающую расслоение металла и вспучивание слоёв (характерно для алюминиевых сплавов);
- подпленочную – протекающую под защитным покрытием металла или ЛКМ.

Виды коррозионных разрушений
Одним из видов местной коррозии является щелевая коррозия, возникающая в местах стыковки, сопряжения конструкций, в щелях, скрытых полостях, зазорах, при прерывистой сварке. Щелевая коррозия может протекать в воздухе, газовой смеси или воде.

На практике проблема осложняется еще и тем, что одно сооружение и даже одно изделие может одновременно подвергаться различным видам коррозии.
Очевидно, что квалифицированное решение задач противокоррозионной защиты реального объекта должно основываться на всестороннем учете всех влияющих обстоятельств: конструкции объекта, среды, окружающих условий, эксплуатационных факторов. Анализ этих обстоятельств позволит сначала определить возможные коррозионные повреждения, а затем правильно наметить конкретные методы и средства защиты.
1.4. ВОЗДЕЙСТВИЕ МЕХАНИЧЕСКОГО ФАКТОРА НА КОРРОЗИОННЫЙ ПРОЦЕСС.
Даже при относительно равномерной коррозии наличие в металле постоянных напряжений, внешних или внутренних, увеличивает скорость коррозии металла в местах концентрации напряжений, что приводит к резкому снижению прочности металлоконструкций.
Коррозия под механическим напряжением
- коррозионно – кавитационные – при воздействии кавитационного процесса;
- эрозионно – коррозионные – при истирающем воздействии потока воды совместно с твердыми частицами (песок, лед и пр.);
- коррозионное растрескивание – при воздействии растягивающих напряжений;
- коррозионная усталость – при воздействии переменных механических напряжений;
- фреттинг – коррозия – при наличии механического воздействия в виде тесного контакта и перемещения относительно друг друга с высокой нагрузкой двух поверхностей.
Из приведенного далеко не полного перечня видно, насколько многообразны коррозионные разрушения, и как тесно они связаны с эксплуатационными условиями и конструктивным исполнением металлоконструкций.
1.5. КЛАССИФИКАЦИЯ КОРРОЗИИ ПО ЭКСПЛУАТАЦИОННЫМ УСЛОВИЯМ
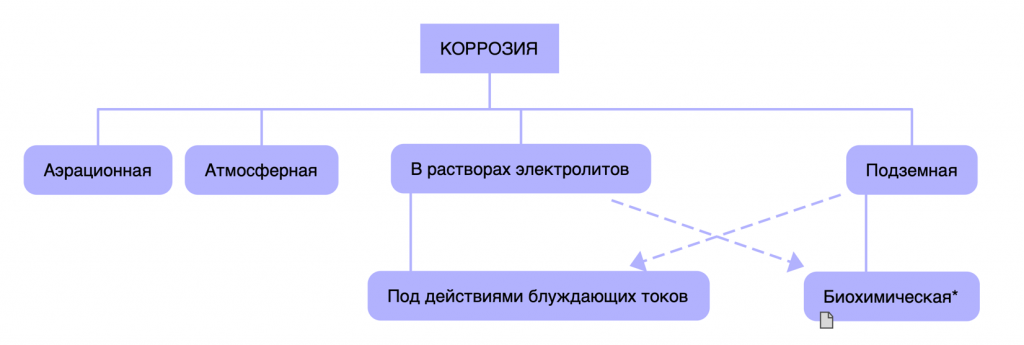
Коррозия по эксплуатационным условиям
1.6. АТМОСФЕРНАЯ КОРРОЗИЯ
1.6.1. СКОРОСТЬ АТМОСФЕРНОЙ КОРРОЗИИ
Атмосферная коррозия – процесс, который происходит при наличии влажного слоя на металлической поверхности. Влажный слой может быть настолько тонок, что он невидим для невооруженного глаза.
Скорость коррозии увеличивается из – за следующих факторов:
- увеличение относительной влажности;
- выпадение конденсации (когда температура поверхности ниже точки росы);
- увеличение количества загрязнения в атмосфере (коррозийные загрязнители могут реагировать со сталью и могут формировать отложения на поверхности).
Опыт показывает, что скорость коррозионных разрушений наиболее значительна, если относительная влаж- ность выше 80 %, а температура около 0 °C. При относительной влажности ниже 40% скорость коррозии близка к 0. Однако при наличии загрязнителей или гигроскопических солей коррозия может происходить и при более низких уровнях влажности. Размещение металлоконструкций также влияет на коррозию. Если конструкция находится на открытом воздухе, то такие климатические факторы, как дождь, солнце, загрязнители в форме газов или аэрозолей влияют на коррозию. Если конструкция находится под покрытием, климатические влияния будут уменьшены. В закрытом помеще- нии эффект атмосферных воздействий минимален, но местный высокий уровень коррозии может быть вызван слабой вентиляцией, высокой влажностью или конденсацией. Для оценки коррозионного напряжения очень важно иметь оценку местной среды и местной микросреды. Пример микросреды – нижняя часть моста (особенно над водой), крыша плавательного бассейна, солнечная или теневая сторона здания.
К дополнительным воздействиям, которые могут вызвать значительное увеличение скорости коррозии или повлечь необходимость в повышенных требованиях к методам защиты от коррозии, следует отнести:
- абразивный износ, который происходит из – за частиц (песка, пыли), переносимых ветром. Поверхности, которые подвержены абразивному влиянию, считаются подверженными среднему или сильному механическому воздействию;
- конденсация, которая возникает, если температура на поверхности конструкции остается ниже точки росы в течение нескольких дней, представляет опасность высокого коррозионного напряжения, особенно, если такая конденсация происходит в течение продолжительных регулярно повторяющихся периодов времени (например, при подводных работах, на трубах охлаждения и т.д.); температуры как средние от + 60 °C до + 150 °C, так и высокие от + 150 °C до + 400 °C могут быть при наличии особых условий, во время строительства или во время работы (например, средние температуры – при наложении асфальта на дорогах, высокие температуры – в дымоходах, сделанных из листовой стали, газовых трубопроводах, или газовых магистралях на коксохимических заводах);
- коррозия может развиваться быстрее на поверхностях, подвергнутых одновременно механическим
и химическим воздействиям. Это касается, в частности, стальных конструкций, расположенных возле дорог, на которых лежит гравий и соль. Проходящие транспортные средства будут разбрызгивать соленую воду и бросать гравий на все части таких конструкций. При этом поверхность будет подвержена коррозионным воздействиям соли и, в то же время, механическому воздействию гравия. Другие части конструкции будут увлажнены распылением соленой воды. Это влияет, например, на нижнюю часть транспортных средств и дорожных металлоконструкций на дорогах, очищаемых ото льда с применением реагентов содержащих соли. Зона распыления простирается на расстояние до 15м от дороги.

1.6.2. КЛИМАТИЧЕСКИЕ УСЛОВИЯ
Атмосферная влажность и температура воздуха зависят от климата региона, в котором расположены металлоконструкции.
По классификации международного стандарта ISO 12944–2 атмосферную среду разделяют на шесть атмосферно – коррозионных категорий:
| C1 Очень низкая | C4 Высокая |
| C2 Низкая | C5 очень высокая |
| C3 Средняя | СХ экстремальная |

Таблица определяет категорию коррозионности при потере массы или толщины стандартных образцов, изготовленных из низкоуглеродистой стали или цинка, после первого года действия.
| Массовая потеря или потеря толщины (после первого года воздействия) |
Примеры типичных окружающих условий в умеренном климате |
|||||
|---|---|---|---|---|---|---|
| Категория коррозионности | Низкоуглеродистая сталь |
Цинк |
Внешний |
|||
| Потеря массы г/м2 | Потеря толщины, мкм | Потеря массы, г/м2 | Потеря толщины, мкм | |||
| C1 очень низкая | менее 10 | менее 1,3 | менее 0,7 | менее 0,1 | Отапливаемые помещения с чистой атмосферой, например, офисы, магазины, школы, гостиницы | |
| C2 низкая | От 10 до 200 | от 1,3 до 25 | От0,7 до 5 | от 0,1 до 0,7 | Атмосфера с низким уровнем загрязнения. В основном сельские районы | Не отапливаемые помещения, где может быть конденсация, например, депо, спортивные залы |
| C3 средняя | от 200 до 400 | от 25 до 50 | от 5 до 1 5 | от 0,7 до 2,1 | Городские или промышленные атмосферы, умеренное загрязнение сернистым ангидридом. Прибрежные территории с низким уровнем солености | Производственные комнаты с высокой влажностью и некоторым загрязнением воздуха, например, заводы по переработке продуктов питания, прачечные, пивоваренные и молочные заводы |
| C4 высокая | От 400 до 650 | От 50 до 80 | От 15 до 30 | От 2,1 до 4,2 | Промышленные и прибрежные территории с умеренной соленостью |
Химические заводы, плавательные бассейны, прибрежные верфи и судоремонтные заводы |
| C5 очень высокая | от 650 до 1500 | от 80 до 200 | от 30 до 60 | от 4,2 до 8,4 | Промышленные зоны с высокой влажностью и агрессивной атмосферой | Здания или площади с почти постоянной конденсацией и с очень высоким загрязнением |
| СХ экстремальная | От1500 до 5500 | От 200 до 700 | От 60 до 180 | От 8,4 до 25 | Морские районы с высокой соленостью и промышленные зоны с экстремальной влажностью и агрессивной атмосферой, и субтропической и тропической атмосферой |
Индустриальные зоны с экстремальной влажностью и агрессивной атмосферой |
Примечание 1. Значения потерь, приведенные для различных категорий коррозии, идентичны данным ISO 9223
Обычно по типу климата можно сделать только общие заключения о коррозии. В холодном или сухом климате уровень коррозии будет ниже, чем в умеренном климате; самый высокий уровень коррозии будет в жарком и влажном климате, а также в морском климате, хотя могут быть значительные местные отклонения.
Основным фактором может быть период времени, в течение которого конструкция подвергается высокой влажности.
Таблица Рассчитанное время увлажнения и температурные характеристики различных типов
| Тип климата |
Экстремальные значения за год |
Рассчитанное время увлажнения при RH>80% и t>0°С, ч ⁄ год | ||
|---|---|---|---|---|
| Самая низкая температура, °С | Самая высокая температура, °С | Самая высокая температура с RH>95%, °C | ||
| Очень холодный | –65 | 32 | 20 | 0–100 |
| Холодный | –50 | 32 | 20 | 150-2500 |
| Умеренно холодный Умеренно теплый | –33 –20 |
34 35 |
23 25 |
2500–4200 |
| Теплый сухой Умеренно горячий Горячий сухой |
–20 –5 3 |
40 40 55 |
27 27 28 |
10–1600 |
| Теплый сырой Теплый сырой, умеренный |
5 13 |
40 35 |
31 33 |
4200–6000 |
Сопоставление условий эксплуатации по международному стандарту ISO 12944–2 и Российским стандартам приведено в Таблица 7
| ISO 12944 – 2:2017 | ГОСТ 15150 (тип) ГОСТ 9.039 (климат и категория размещения ГОСТ 9.032) | СП 28.13330.2017 |
|---|---|---|
| С4 | Тип II (промышленная), УХЛ 1, ХЛ 1 | Средне- и сильноагрессивная |
| С5 | Тип II (промышленная) / Тип III (морская) / Тип IV (приморская-промышленная) УХЛ 1, ХЛ 1, У1 | Сильноагрессивная |
| Im1 | Группа 4 (4/1) | Среднеагрессивная пресная вода РH 5 – 11, соленость < 5% |
| Im2 | Группа 4 (4/2) | Среднеагрессивная морская вода РH 6 – 8,5, соленость < 20 – 50% |
| Im3 | Группа 4 ,7 | От слабо до сильно агрессивной в зависимости от климатических условий и характеристики грунтовых вод |
1.7. КОРРОЗИЯ ВНУТРИ ПОМЕЩЕНИЯ
Коррозионное воздействие на стальные конструкции, расположенные внутри помещений и защищенные от окружающей среды, обычно, незначительно. Более охлажденные участки на конструкциях могут быть подвер- жены более высокому коррозионному воздействию в результате сезонного образования конденсата.
В случаях, когда поверхность увлажняется электролитами, даже если такое увлажнение только временное (например, пропитанные строительные материалы), также наблюдается усиление коррозии.
Если внутренняя часть здания только частично защищена от окружающей среды, воздействие коррозии может быть оценено, как для атмосферы, окружающей это здание.
Значительно возрастает скорость коррозии в цехах коксохимических, гальванических, лакокрасочных, дерево- обрабатывающих и кожевенных заводов, предприятиях по производству минеральных удобрений, на нефтедобывающих и нефтеперерабатывающих предприятиях из – за загрязнителей, появляющихся в результате работы завода (например, кислот, щелочей или солей, органических растворителей, агрессивных газов и частиц пыли).

Аналогично по вышеперечисленным причинам повышение скорости коррозионных разрушений происходит в непроизводственных помещениях, например, в закрытых плавательных бассейнах с хлорированной водой, помещениях для содержания домашних животных и других зданиях специального назначения.
1.8. КОРРОЗИЯ В ЕМКОСТЯХ И ПОЛЫХ КОНСТРУКЦИЯХ
Герметично запечатанные полые конструкции (элементы конструкций) практически не подвержены внутренней коррозии. Конструкции, которые по условиям эксплуатации подразумевают периодическое открытие, подвер- жены незначительной степени коррозионного воздействия.
Проектирование полых запечатанных конструкций и емкостей должно гарантировать их герметичность (необходимо обеспечить сплошность сварочных швов, герметичное уплотнение винтовых соединений), иначе изменение внешней температуры или влажности воздуха могут привести к повышенной влажности внутри кон- струкции. Если возникновение подобных условий обусловлено конструкцией элемента и условиями эксплуатации конструкции, внутренняя поверхность требует защиты от коррозии. Конденсация часто наблюдается в емкостях с плотно закрывающимися крышками.
1.9. АЭРАЦИОННАЯ КОРРОЗИЯ
Аэрационная коррозия обуславливается неравномерным доступом кислорода к поверхности металла. Это явление получило название принципа неравномерной аэрации, а коррозия при таких условиях – аэрационной коррозии. Рассмотрим механизм коррозии стали под каплей воды.

В этом случае кислород быстрее проникает к поверхности стали по краям капли (зона I), чем в центре (зона II). Разность концентраций растворённого молекулярного кислорода в центре капли и на её краях обуславливает разность электродных потенциалов на этих участках поверхности стали, в результате чего образуется микро- гальванический концентрационный элемент. Причем края капли становятся катодом, а центр – анодом. При этом имеют место следующие процессы:
на катоде (−) К: О2 + 2Н2О + 4е– 4ОН–, на аноде (+) А: Fe0 – 3e– Fe3+,
Fe3+ +3OH– Fe(OH)3, или
FeО – 2e– Fe2+,
Fe2+ +2OH–Fe(OH)2, 4Fe(OH)2 + O2 +2H2O4Fe(OH)3.
Данный механизм является одной из причин точечной коррозии металла или питтинга, в результате которой поверхность металлической конструкции или изделия изъязвляется и покрывается мелкими, но нередко доста- точно глубокими отверстиями.
1.10. КОРРОЗИЯ ПРИ ПОГРУЖЕНИИ В ВОДНЫЕ РАСТВОРЫ ЭЛЕКТРОЛИТОВ
В зависимости от условий эксплуатации и состояния средств противокоррозионной защиты скорость коррозии подводной части морских сооружений может изменяться в широких пределах. Например, при использовании стали с прокатной окалиной и отсутствии эффективных средств защиты могут иметь место интенсивные язвен- ные поражения до 1 мм ⁄ год. В случае электрокоррозии под действием блуждающих токов или вследствие неправильного электроснабжения сварочных работ при постройке или ремонте коррозионные повреждения могут развиваться со скоростью до 5 мм ⁄ год.
На свайных основаниях, оснащенных современными средствами защиты, коррозия в подводной зоне, как правило, носит равномерный характер, и скорость ее не превышает 0,08 мм ⁄ год.
Повышенные скорости коррозии (до 0,4 мм ⁄ год) имеют место в подводной части гидротехнических сооружений в замерзающих морях, где лакокрасочные покрытия разрушаются значительно быстрее, а разрушения носят эрозионно – коррозионный характер.
Зона переменного смачивания, как и подводная часть, подвергается воздействию морской воды, однако имеются и специфические отличия, влияющие на характер коррозии:
- повторно – периодическое воздействие морской воды и атмосферы, т.е. отсутствие диффузионных ограничений по кислороду;
- воздействие плавающего слоя нефтепродуктов;
- механическое разрушение лакокрасочного покрытия при швартовках, в битом льду и т.п. Средняя скорость коррозии в этой зоне несколько больше, чем в подводной части (0,15–0,25 мм ⁄ год), а макси- мальная скорость язвенной коррозии может составлять до 1 мм ⁄ год. В качестве средства защиты в этой зоне используются лакокрасочные покрытия, причем к ним предъявляются дополнительные требования: стойкость в морской воде, атмосфере при периодическом воздействии нефтепро- дуктов и высокая стойкость к абразивному износу.

Для конструкций, эксплуатирующихся в воде и почве, характерна местная коррозия. В Таблице приведены категории и примеры для этих конструкций.
Категории окружающей среды для погруженных конструкций
| Категория | Окружение | Образцы окружающей среды и конструкций |
|---|---|---|
| Im1 | Пресная вода | Речные сооружения, гидроэлектростанции |
| Im2 | Морская или солоноватая вода |
Погруженные конструкции без катодной защиты (т.е. гавани с инфраструктурой) |
| Im3 | Почва | Заглубленные цистерны, стальные сваи, стальные трубопроводы |
| Im4 | Морская или солоноватая вода |
Погруженные конструкции с катодной защитой (т.е. офшорные конструкции) |

Коррозия сваи в зоне забрызгивания
1.11. КОРРОЗИЯ В НЕФТИ И НЕФТЕПРОДУКТАХ
Изобр. 9 Коррозия сваи в зоне забрызгивания (примеры)
Поступающая из скважин продукция не является однофазной системой, нефтью или газом. Из скважин вместе с нефтью и газом поступают пластовая вода, попутный нефтяной газ, твердые частицы горных пород, затвердев- шего цемента (шлам).
Пластовая вода в результате перекачки нефти перемешивается в единую фракцию с сырой нефтью, образуя водно-нефтяную эмульсию .
Кроме углеводородов в нефтегазовых продуктах присутствуют сера от 0,1 до 1-2%, иногда до 5-7%; азот от 0,001 до 1-2%, иногда до 1,7%; кислород в виде различных соединений от 0,001 до 1% и более, но не превышает 3,6%. В нефти присутствуют железо, магний, алюминий, медь, олово, натрий, кобальт, хром, германий, ванадий, никель, ртуть, золото и прочие в количестве менее 1%.
При хранении в резервуаре сырая нефть разделяется на фракции, происходят процессы коагуляции (самопро- извольный процесс укрупнения частиц дисперсной фазы) капель воды, и более крупные и тяжелые капли воды под воздействием силы тяжести (гравитации) оседают на дно в виде слоя подтоварной воды .
В результате в нижней части резервуаров скапливается подтоварная вода при хранении нефти и нефтепро- дуктов. Эти воды, как правило, минерализованы, содержат в себе агрессивные растворы кислот, солей и газов. Подтоварная вода является причиной коррозионных разрушений нижнего пояса резервуаров, что требует принятия усиленных мер по защите от коррозии этого района конструкции.
Верхняя часть резервуара подвержена воздействию паровоздушной смеси, сероводорода, углекислого газа.
Эти факторы приводят к тому, что внутренняя поверхность резервуаров хранения сырой нефти могут окра- шиваться не полностью, а только днище и нижний пояс, где скапливается подтоварная воде, а также крыша и верхний пояс для защиты от паров и газов.
Для защиты резервуаров под светлые нефтепродукты окраске подлежит вся внутренняя поверхность. Это требование обусловлено тем, что важно не только защитить резервуар от коррозии, но и уберечь нефтепродукты от попадания в них продуктов коррозии и от ухудшения их качества, которое может быть вызвано контактом нефтепродуктов с непокрытой сталью.
При защите внутренней поверхности резервуаров под нефтепродукты иногда выдвигается требования токопроводности ЛКМ, связанное с конструктивными особенностями резервуара и накапливанием статического электричества на его стенках.
- При окраске трубопроводов для транспортировки нефти, нефтепродуктов и газов необходимо учитывать следующие факторы:
- Наличие водяных паров в газе приводит к коррозии трубопроводов и оборудования и к образованию в трубопроводах гидратов, способных перекрыть сечение трубы.
- Конденсат тяжелых углеводородов оседает в пониженных точках газопроводов, уменьшая их проходное сечение.
- Сероводород способен в присутствии влаги образовывать растворы серноватистой и серной кислоты, резко увеличивающих скорость коррозии труб, арматуры и оборудования.
- Углекислый газ также приводит к коррозии оборудования.
1.12. ПОДЗЕМНАЯ КОРРОЗИЯ
Почвенная или грунтовая коррозия приводит к разрушению подземных трубопроводов, свай, опор и других строительных сооружений. Наличие в почвах и грунтах влаги определяет электрохимический характер подзем- ной коррозии. Агрессивные свойства любого грунта (почвы) определяются их пористостью, влажностью, аэрацией, рН среды, электропроводностью, наличием растворенных солей. Влажность грунта определяет скорость подземной коррозии. Наиболее интенсивно протекает коррозия при его влажности около 20%. При содержании влаги более 20% коррозия замедляется. Это объясняется тем, что повышение влажности грунта препятствует проникновению атмосферного кислорода и возникновению коррозионных элементов. На скорость подземной коррозии влияет рН почвенного раствора. Особенно велика коррозия в торфяных и заболоченных грунтах, в которых рН=3.
1.13. КОРРОЗИЯ ПОД ДЕЙСТВИЕМ БЛУЖДАЮЩИХ ТОКОВ
Одним из видов коррозии в условиях погружения в электропроводящих средах является коррозия под действием блуждающих токов. Скорости коррозии в таких условиях достигают значительных величин. Блуждающими токами называются токи, ответвляющиеся от своего пути.
Их источником служат рельсовые пути трамвайных и железных дорог, сварочные агрегаты, электролизеры и пр.
